- Estructuras cristalinas
- Puntos, direcciones y planos de una celda unitaria
- Las Celdas Tridimensionales
- Puntos, planos y direcciones en una celda unitaria.
- Sitios intersticiales
- Cristale iónicos y covalentes
- Transformaciónes alotrópicas o polimórficas
- Difracción de Rayos-X
http://webdelprofesor.ula.ve/ingenieria/marquezronald/wp-content/uploads/2009/08/2_Organizaci%C3%B3n-at%C3%B3mica.PDF
http://www.upct.es/~dimgc/webjoseperez/DOCENCIA_archivos/Aplicaciones_DRX_Apuntes_y_ejercicios.PDF
orden de corto y largo alcance
En los materiales cristalinos, las partículas componentes muestran un ordenamiento regular que da como resultado un patrón que se repite en las tres dimensiones del espacio, y a lo largo de muchas distancias atómicas. Los sólidos cristalinos poseen internamente un orden de largo alcance. La situación en un cristal es tal que el entorno de un determinado tipo de átomo siempre es el mismo (los mismos átomos vecinos y a idénticas distancias).En los materiales amorfos, los átomos siguen un ordenamiento muy localizado, restringido a pocas distancias atómicas y que, por tanto, no se repite en las tres dimensiones del espacio. Se habla de un orden local o de corto alcance. En la siguiente figura se ilustran los conceptos de largo y corto alcance, en un esquema bidimensional.
 | ||||
Ilustración de los conceptos: (izq.) de orden de largo alcance y (dcha.) de corto alcance. Obsérvese cómo en este último el orden sólo se restringe a ciertas zonas. Los puntos pueden representar un átomo, una molécula o un grupo de átomos o moléculas.}
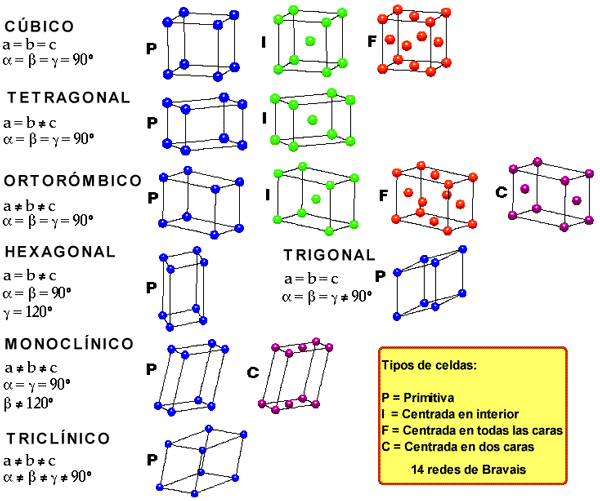 caras (F). cristales iónicos y covalentesLa estructura y propiedades, como densidad, dureza y punto de fusión, de los cristales, están determinados por el tipo de fuerzas que mantienen unidas a las partículas. Un cristal podrá clasificarse dentro de uno de estos grupos: iónico, covalente, molecular o metálico. Los cristales iónicos poseen dos características importantes. La primera es que están formados por especies cargadas; y la segunda, es que los aniones y cationes suelen ser de distintos tamaños. La mayoría de los cristales iónicos tienen puntos de ebullición elevados, que refleja la gran fuerza de cohesión que mantiene juntos a los iones. La estabilidad de los cristales iónicos depende de la energía reticular; cuanto mayor es esta energía, más estable es el compuesto. Además, lo sólidos cristalinos no conducen la electricidad ni el calor, debido a que los cationes y aniones se encuentran en posiciones fijas. En el estado fundido o disueltos en agua, los iones recuperan la movilidad y se convierten en buenos conductores. Además presentan elevados puntos de fusión y son quebradizos. El cloruro de sodio es un ejemplo de cristal iónico. Los cristales iónicos poseen dos características importantes. La primera es que están formados por especies cargadas; y la segunda, es que los aniones y cationes suelen ser de distintos tamaños. La mayoría de los cristales iónicos tienen puntos de ebullición elevados, que refleja la gran fuerza de cohesión que mantiene juntos a los iones. La estabilidad de los cristales iónicos depende de la energía reticular; cuanto mayor es esta energía, más estable es el compuesto. Además, lo sólidos cristalinos no conducen la electricidad ni el calor, debido a que los cationes y aniones se encuentran en posiciones fijas. En el estado fundido o disueltos en agua, los iones recuperan la movilidad y se convierten en buenos conductores. Además presentan elevados puntos de fusión y son quebradizos. El cloruro de sodio es un ejemplo de cristal iónico. Los átomos en los cristales covalente se mantienen unidos en una red tridimensional por enlaces covalentes. Las propiedades en este tipo de cristales no siguen una línea específica. Por ejemplo, el diamante, presente hibridación sp3 en cada uno de sus átomos; este enlace en tres dimensiones es fuerte y contribuye con la dureza particular del diamante (es el material más duro que se conoce) y con su elevado punto de fusión (3350°C). Su alótropo el grafito, presenta átomos con hibridación sp2 y un orbital 2p remante sin hibridar. En esta estructura los electrones pueden moverse libremente, lo que hace al grafito buen conductor. A diferencia del diamante, el grafito es menos duro y se presenta untuoso al tacto debido a que las capas se mantienen unidas por simples fuerzas de van der Waals, por lo que se pueden deslizar entre sí. Esta propiedad lo hace buen lubricante. Los átomos en los cristales covalente se mantienen unidos en una red tridimensional por enlaces covalentes. Las propiedades en este tipo de cristales no siguen una línea específica. Por ejemplo, el diamante, presente hibridación sp3 en cada uno de sus átomos; este enlace en tres dimensiones es fuerte y contribuye con la dureza particular del diamante (es el material más duro que se conoce) y con su elevado punto de fusión (3350°C). Su alótropo el grafito, presenta átomos con hibridación sp2 y un orbital 2p remante sin hibridar. En esta estructura los electrones pueden moverse libremente, lo que hace al grafito buen conductor. A diferencia del diamante, el grafito es menos duro y se presenta untuoso al tacto debido a que las capas se mantienen unidas por simples fuerzas de van der Waals, por lo que se pueden deslizar entre sí. Esta propiedad lo hace buen lubricante.Transformaciones alotrópicas o polimorfas
Los materiales que pueden tener más de una estructura cristalina se llaman alotrópicos o
polimórficos. El término alotropía se reserva para este comportamiento en elementos puros,
mientras que polimorfismo es más general. En la tabla se ve como el hierro y el titanio pueden
tener más de una estructura cristalina; a bajas temperaturas el hierro es BCC pero a
temperaturas más altas se convierte en FCC.
Muchos cerámicos como el SiO2 son polimórficos. La transformación puede venir
acompañada de un cambio de volumen durante el calentamiento o enfriamiento. De no estar
controlada correctamente, este cambio hará que el material se agriete y falle.
Difracción de los rayos x
La difracción de rayos X es uno de los fenómenos físicos que se producen al interaccionar un haz de rayos X, de una determinada longitud de onda, con una sustancia cristalina. La difracción de rayos X se basa en la dispersión coherente del haz de rayos X por parte de la materia (se mantiene la longitud de onda de la radiación) y en la interferencia constructiva de las ondas que están en fase y que se dispersan en determinadas direcciones del espacio.
El fenómeno de la difracción puede describirse con la Ley de Bragg, que predice la dirección en la que se da interferencia constructiva entre haces de rayos X dispersados coherentemente por un cristal |
No hay comentarios.:
Publicar un comentario