SEMANA 4
https://cienciamateriales.files.wordpress.com/2012/08/diagrama-de-fases-4.pdfSustancias Puras
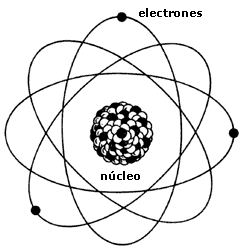
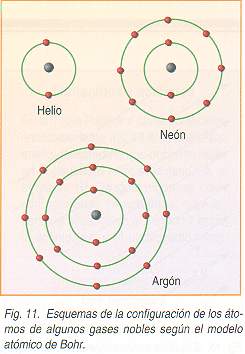
Las sustancias puras están formadas por átomos o moléculas todas iguales, tienen propiedades específicas que las caracterizan y no pueden separarse en otras sustancias por procedimientos físicos. Las sustancias puras se clasifican en elementos y compuestosElemento
Los elementos también pueden llamarse sustancias puras simples y están formados por una sola clase de átomos, es decir, átomos con el mismo número de protones en su núcleo y por lo tanto con las mismas propiedades químicas. Los elementos no pueden descomponerse en otras sustancias puras más sencillas por ningún procedimiento. Son sustancias puras simples todos los elementos químicos de la tabla periódica. A las sustancias formadas por moléculas compuestas por átomos iguales también se les considera elementos, por ejemplo el oxígeno gaseoso, oxígeno molecular o dioxígeno.Compuesto
Los compuestos son sustancias formadas por la unión de dos o más elementos de la tabla periódica en proporciones fijas.Una característica de los compuestos es que poseen una fórmula química que describe los diferentes elementos que forman al compuesto y su cantidad. Los métodos físicos no pueden separar un compuesto, éstos solo pueden ser separados en sustancias más simples por métodos químicos, es decir, mediante reacciones.
Por ejemplo, el agua es una sustancia pura, pero si la sometemos a electrólisis la podemos separar en los elementos que la forman, el oxígeno y el hidrógeno.
Mezcla
Una mezcla resulta de la combinación de dos o más sustancias donde la identidad básica de cada una no se altera, es decir, no pierden sus propiedades y características por el hecho de mezclarse, porque al hacerlo no ocurre ninguna reacción química.Por ejemplo, si se mezcla limadura de hierro con azufre, cada sustancia conserva sus propiedades. La composición de las mezclas es variable, las sustancias que componen a una mezcla pueden presentarse en mayor o menor cantidad. Otra característica de las mezclas es que pueden separarse por métodos físicos.
En la mezcla de hierro y azufre puede utilizarse la propiedad de magnetismo que presenta el hierro para ser separado del azufre.
Mezcla homogénea
Las mezclas homogéneas se llaman también disoluciones. Tienen una apariencia totalmente uniforme por lo que sus componentes no pueden distinguirse a simple vista. Se dice que este tipo de mezclas tiene una sola fase. En química se denomina fase a una porción de materia con composición y propiedades uniformes. Por ejemplo, el agua de mar está formada por agua y muchas sales solubles, donde se observa una sola fase.Mezcla heterogénea
Las mezclas heterogéneas presentan una composición no uniforme, sus componentes pueden distinguirse a simple vista, en otras palabras, se observan diferentes sustancias en la mezcla. Los componentes de este tipo de mezcla existen como regiones distintas que se llaman fases. Una mezcla heterogénea se compone de dos o más fases. Si observas la piedra de granito, puedes ver zonas de distinto color que indican que la roca está formada de cristales de distintas sustancias.SOLUCIONES SÓLIDAS
Son muy pocos los metales que se utilizan de forma pura o casi pura, pues la mayoría de ellos se combinan con otros metales o no metales para conseguir materiales de mayor dureza, resistencia mecánica, resistencia a lacorrosión u otras propiedades. Estos materiales se conocen con el nombre de aleaciones
En toda aleación se debe cumplir:
— Los elementos a mezclar deben ser totalmente miscibles en estado liquido, para que al solidificar se origine un producto homogéneo.
—— El producto obtenido debe poseer carácter metálico; es decir, su estructura interna ha de ser igual que la de los metales.
Algunos ejemplos los tenemos en el latón ( tiene el 70% de cobre y 30% de cinc ) u otras más complejas como las aleaciones a base de níquel utilizadas en motores a reacción, en cuya composición existen unos diez elementos .
Al elemento que aporta la mayor proporción se le denomina disolvente y soluto al de menor proporción.
La aleación cristaliza según la misma red tridimensional del disolvente.
Si lo anterior no se cumple, o sea, la red que se adopta es la del elemento que aporta menos parte de la mezcla, es a éste al que se denomina disolvente
Las soluciones sólidas pueden ser de dos tipos
— De sustitución, cuando algunos átomos de la red cristalina del metal se encuentran sustituidos por átomos de otro metal diferente.
— De inserción, cuando en los espacios interatómicos de la red cristalina de un metal se introducen átomos extraño.
Soluciones Sólidas de sustitución
Las condiciones que se deben cumplir son• Ambos metales han de cristalizar en el mismo sistema.
• Debe tener la misma valencia y por tanto el número de electrones que ceden a la nube electrónica es el mismo.
• Electronegatividad: Debe e ser lo mas parecida posibles.
• Los diámetros atómicos no deben diferir en más de un 15%.
Se puede dar el caso que aún cumpliéndose todas las condiciones anteriores, la solubilidad no sea total, o sea solo admita un determinado porcentaje. El cobre y el Níquel la forma de forma ilimitada pero no otros
ALEACIÓN POR SOLUCIÓN SÓLIDA DE INSERCIÓN
En este caso, los átomos de soluto se introducen en los intersticios existentes en la red cristalina del disolvente.
Se cumple cuando el tamaño de los átomos del soluto es muy pequeño comparado con el disolvente. Ejemplos son Carbono, Oxígeno, Nitrógeno o Hidrógeno.
Un ejemplo es la ferrita (BCC) conde tenemos el carbono en los huecos de la red del hierro.
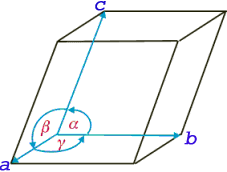
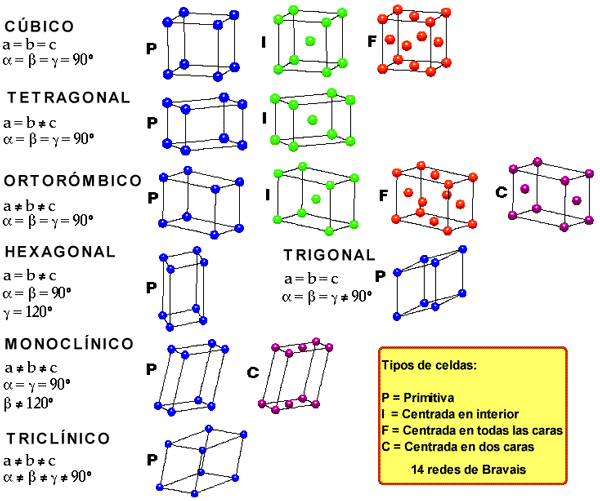
Diagrama de Fases Binarios Los diagramas de fases binarios tienen sólo dos componentes. En ellos la presión se mantiene constante, generalmente a 1 atm. Los parámetros variables son la temperatura y la composición. Los diagramas de fases binarios son mapas que representan las relaciones entre temperatura, composición y cantidad de fases en equilibrio, las cuales influyen en la microestructura de una aleación. Muchas microestructuras se desarrollan a partir de transformaciones de fases, que son los cambios que ocurren entre las fases cuando se altera la temperatura (en general, en el enfriamiento). Esto puede implicar la transición de una fase a otra, o la aparición o desaparición de una fase.

 Los cristales iónicos poseen dos características importantes. La primera es que están formados por especies cargadas; y la segunda, es que los aniones y cationes suelen ser de distintos tamaños. La mayoría de los cristales iónicos tienen puntos de ebullición elevados, que refleja la gran
Los cristales iónicos poseen dos características importantes. La primera es que están formados por especies cargadas; y la segunda, es que los aniones y cationes suelen ser de distintos tamaños. La mayoría de los cristales iónicos tienen puntos de ebullición elevados, que refleja la gran  Los átomos en los cristales covalente se mantienen unidos en una red tridimensional por enlaces covalentes. Las propiedades en este tipo de cristales no siguen una línea específica. Por ejemplo, el diamante, presente hibridación sp
Los átomos en los cristales covalente se mantienen unidos en una red tridimensional por enlaces covalentes. Las propiedades en este tipo de cristales no siguen una línea específica. Por ejemplo, el diamante, presente hibridación sp